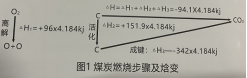
朝旭-节煤剂化学原理介绍从煤炭燃烧的本质看,采用化学干预催化节能是可行的。煤炭燃烧实质上是碳氢化合物被氧化生成CO2、H2O等并放出热能的过程。以C的燃烧过程为例,其化学反应方程式是:C+O2→CO2 △H=-94.1×4.184kJ/mol △H是反应放出的热能,简称“焓变” 焓变的实质是断开或者形成化学键所产生的能量变化。在碳被氧化生成CO2的过程中,有两种化学键发生了变化,其中一种是分子[O2]中氧原子之间的双键被断开,如下式:O=O→O+O 另一种是碳原子和2个氧原子形成的2个碳氧双键,如下式:O+O+C→O=C =O 热力学测定结果表明:断开1mol氧分子双键,需要吸收96×4.184kJ热能;形成1mo1碳氧双键,可以放出171×4.184kJ热能;1个CO2,分子含2个碳氧双键,所以生成1mo1CO2,可放出2×171×4.18kJ热能。如下图1所示。
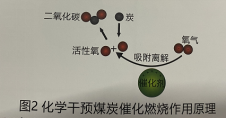
从上图1可以知道,煤炭燃烧实际上是分两步进行的。第一步,氧分子[O2]离解成氧原子[O],其热效应我们用△H1表示。与此同时,碳原子被活化,炭的活化实质是碳原子内的成键电子从低能轨道向高能轨道跃迁,达到成键能态的过程,所需的能量称为活化能,这个能量我们用△H2表示。这一步的两个过程需要吸收大量热能(△H1+△H2),几乎煤炭燃烧所放出的热能有70%被其消耗掉。第二步,氧原子[O]与活化状态下的碳原子化合生成CO2,这一步是个成键反应,放出大量热能。我们用△H3表示,实际上我们平常讲的标准煤发热值不是指第二步反应所放出热量的全部,而是指第二步反应放出热量值与第一步反应所吸收的热量的代数和,我们用方程△H=△H3+(△H1+△H2)来表示。然而,第二步反应所放出的热量是不变的,即△H3是一个恒量。如果能够降低第一步反应所吸收的热量,即减少(△H1+△ H2)的值,就可以提高煤炭的发热量△H。 由以上分析可知,根据表面吸附反应原理,设计带正电荷中心的能吸附氧分子[O2]的催化剂,可使氧分子变形并迅速将它的双键断开变成氧原子[O]。随后,活化了的碳原于和氧原子结合生成CO2分子后离开催化剂表面,如此循环不断,如下图2所示。
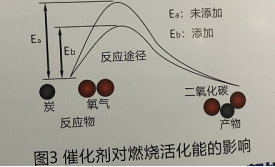
从催化剂能使反应活化能降低,并不改变初始反应物和反应生成终产物的原理,其实质是给反应提供了一条较低能量的反应途径,如图3所示,化学干预煤炭催化节煤剂能够很好的降低煤炭燃烧反应的活化能,即降低燃烧过程的内耗,从而实现根本上、源头上的节能,是化学反应在实践中的应用,属于化学范畴,在正平衡试验中可以得到验证。
ZHAOXU节能减排解决方案提供商
CN:福建朝旭新能源科技有限公司 ADD:福建·晋江 TEL:0595-85557676 FAX:0595-85557676 E-mail:zhaoxukj@126.com Http//:www.cnzhaoxu.com 关注我们
|